Корозія Металів. Захист Від Корозії Реферат
Рефераты doc. КОРОЗІЯ МЕТАЛІВ ЗАХИСТ ВІД КОРОЗІЇ. • Які способи захисту від корозії ви. Название реферата: Корозія металів і способи захисту від корозії. Вы можете скачать реферат 'Корозія металів і способи захисту від корозії' со. Що таке “ корозія ”? Корозія (від лат. Corrosio – роз’їдати) це руйнування. Металів і сплавів. Загальні фізичні властивості металів. Корозія металів, захист від корозії. Реферати kr.jpg фішки.
Детальная информация о работе. Выдержка из работы Литература 1. Антонченко, В. Основы физики воды Текст / В. Антонченко, А.
Eisenberg, D. The structure and properties of water Text / D. Eisenberg, W. — Oxford University press, 2005. In Water: A Comprehensive Treatise Text / A. — New York: Plenum Press, 1982.
Физические свойства и структура воды Текст / Г. — М.: Изд-во МГУ, 1987.
Frozen Food Technology Text / C. — London: Published by Springer, 2012. О взаимодействиях и динамике молекул в чистой воде Текст / Н. Малафаев // Восточно-Европейский журнал передовых технологий. The Jahn-Teller Effect and Vibronic Interactions in Modern Chemistry Text / I.
— New York: Published by Plenum, 1984. Intermolecular interactions: from diatoms to biopolimers Text / B. — New York, 1978.
Water and proteins: a love-hate relationship Text / Y. Onuchic // Proceedings of the National Academy of Sciences of the United States of America. Schneider, B. Hydration of the phosphate group in double-helical DNA Text / B.
Schneider, K. Berman // Biophysical Journal.
Ebbinghaus, S. An extended dynamical hydration shell around proteins Text / S.
Ebbinghaus, S. Havenith // Current Issue. Frauenfelder, H. The role of structure, energy landscape, dynamics, and allostery in the enzymatic function of myoglobin Text / H.
Frauenfelder, B. Groves // Proceedings of the National Academy of Sciences of the United States of America.??- В роботі було досліджено корозійні процеси та визначено рівень активності різних водних середовищ щодо металів. Визначено вплив рН, температури та мінералізації на швидкість корозії металів. Встановлено, що корозійна активність нейтрального водного середовища залежить від концентрації розчиненого кисню та від вмісту аніонів солей у воді. Доведено, що розчинені неорганічні солі суттєво прискорюють процес корозії Ключові слова: корозійна активність, метали, кисень, мінералізація, швидкість корозії, пасиваційна киснева плівка?-? В работе были исследованы корозионные процессы и определен уровень корозионной активности различных водных сред по отношению к металлам.
Корозія Металів Захист Від Корозії Реферат
Определено влияние рН, температуры и минерализации на скорость коррозии металлов. Установлено, что коррозионная активность нейтральной водной среды зависит от концентрации растворенного кислорода и от содержания анионов солей в воде.
Доказано, что растворенные неорганические соли существенно ускоряют процес коррозии Ключевые слова: корозионная активность, металлы, кислород, минерализация, скорость коррозии, пассивационная кислородная пленка -??- УДК 547. 257 ОЦІНКА ВПЛИВУ ФІЗИКО-ХІМІЧНИХ ФАКТОРІВ НА КОРОЗІЙНУ АКТИВНІСТЬ ВОДИ А.
Тамазашвілі Аспірант. Е-mail: tamazashvili@gmail. М аз н а. Е-mail: yulyamaznaya@mail. Малихіна.
Е-mail: yulyamaznaya@mail. Гомеля Доктор технічних наук, профессор, завідуючий кафедри. Е-mail: m.
Ua.Кафедра екології та технології рослинних полімерів Національний технічний університет України «Київський політехнічний інститут» пр. Перемоги, 37, м. Київ, Україна, 3 056 1.
Вступ Питання захисту металів від корозії у воді та водних розчинах є дуже важливим, оскільки в промисловості, комунально-побутових господарствах та природних умовах найбільш розповсюдженим випадком є руйнування обладнання і конструкцій саме у водному середовищі. 2013 € Усп ішний захист металевих водопровідних труб від корозії є однією з важливих задач.
Корозія Металів Захист Від Корозії Презентація
Корозія металевих труб, особливо, сталевих, веде до величезної даремної витрати металу, скорочує термін служби водопровідних ліній, є причиною аварій, збільшує шорсткість внутрішньої поверхні стінок труб і, отже, втрати напору в них, що пов’язане з додатковими витратами на подачу води. Таким чином, корозія труб викликає збільшення як будівельних, так і експлуатаційних витрат в систев мах водопостачання 1.
Огляд стану питання Корозія металевих труб у водопровідній мережі є складним електрохімічним та фізико-хімічним процесом, що відбувається на поверхні металу і залежить від корозійних властивостей води, які не завжди можуть бути усунені, але зазвичай можуть контролюватися економічно доцільним способом 2. Корозійна активність води залежить від хімічних факторів, таких як рН, лужність, розчинений кисень, загальний вміст розчинених твердих речовин і фізичних властивостей, таких як температура, витрата і швидкість руху води, а також природа матеріалу труби 3 — 5. У процесі очищення води, можна впливати на рН, лужність і жорсткість за кальцієм, каламутність та кольоровість води для контролю процесів корозії та для запобігання внутрішній корозії систем розподілу води 6, 7. Тому в даній роботі було вивчено процеси корозії металів у водних середовищах при р ізних концентраціях солей та окисників та при різних умовах: температурах, рН, аерації.
Експериментальні дослідження, аналіз та інтерпретація отриманих результатів Були проведені дослідження з визначення короз ійної активності водних середовищ щодо різних металів: сталі Ст. 3, сталі 20, нержавіючої сталі 12Х18Н10Т, міді М-2 і латуні Л62. Оцінку корозійної активності проводили в статичних і динамічних умовах (при перемішуванні води магнітною мішалкою) в діапазоні температур 15 — 75 °C.
Тривалість випробувань до 200 годин. Швидкість корозії визначали масометричним методом та методом поляризаційного опору. Результати випробувань отримували усередненням даних з 4 — 6 паралельних дослідів 8, 9. Поляризаційний опір — величина, обернена швидкості корозії: У=К^рСер, (1) де V — швидкість корозії, мм/рік- К — константа, мм/рік/Ом, RpСep — поляризаційний опір, Ом. Про вплив рН середовища на корозійну агресивність води можна судити по рис. 1. З підвищенням рН середовища середнє значення поляризаційного опору дистильованої води (С (Na2SO4) = 0,02 г/дм3) при використанні зразків із сталі20 зростає.
Це обумовлено зниженням концентрації протонів у воді, що сприяє зниженню швидкості корозії з водневою деполяризацією. В статичних умовах максимальне значення середнього поляризаційного опору досягнуте при рН = 12 і сягає Rpсep = 556,5 Ом. В даному випадку, не дивлячись на зростання середнього поляризаційного опору, швидкість корозії є ще досить значною. Це обумовлено тим, що в статичних умовах дифузія кисню недостатня для створення стабільної пасиваційної плівки, але достатня для окислення металу. 1500 1300 1100 О 900. «700 ОС 500 300 8 9 10 11 12 13 pH Рис. 1. Залежність поляризаційного опору електродів із сталі Ст. 20 у дистильованій воді від реакції середовища Примітка: 1 — статичні умови- 2 — динамічні умови Відомо, що для водопровідної води, артезіанської води та води з поверхневих водойм поляризаційний опір в статичних умовах може сягати 500 — 800 Ом.
Очевидно, що досить значна швидкість корозії при рН = 12 обумовлена, в даному випадку, кисневою деполяризацією, внаслідок достатньої розчинності кисню у воді. В динамічних умовах зростання поляризаційного опору з ростом рН середовища виражено в більшій мірі. В даному випадку, як і в статичних умовах, із зростанням рН вклад водневої деполяризації корозії зменшується. В динамічних умовах при високих значеннях рН середовища, не дивлячись на кращу дифузію кисню до поверхні сталі, швидкість корозії знижується.
Ймовірно, це обумовлено утворенням пасиваційної плівки на поверхні сталі. За низьких значеннь рН середовища пасивацйна плівка, що утворюється в динамічних умовах, недостатньо ефективна, щоб нейтралізувати процес із водневою деполяризацією. Про вплив кисню на процес корозії сталі у воді можна судити по результатам, які приведено в табл. В даному випадку вміст кисню регулювали за рахунок зміни концентрацій сульфіту натрію у воді. Досліди із сульфатом натрію проводили, щоб оцінити вплив неорганічної солі на корозійну активність води. Вплив сульфату натрію був близьким до сульфіту натрію, тому що солі використовувалоись в однакових концентраціях.
Як видно з табл. 1, при кімнатній температурі, за умов зниження концентрації кисню (реагент сульфіт натрію), швидкість корозії знижувалася, що видно по підвищенню поляризаційного опору, при цьому при використанні Na2SO4 до рН=9 з підвищенням вмісту сульфату натрію швидкість корозії зростає. При рН=9,6 подальшого зростання швидкості корозії із підвищенням концентрації №^04 не відмічено. В меншій мірі сульфіт натрію впливає на корозію сталі 20 при температурі 75 °C. В даних умовах розз чинність кисню у воді низька настільки, що не за- З лежить від вмісту № 2803, а її корозійна активність визначається прискоренням реакції окислення заліза при підвищенні температури.
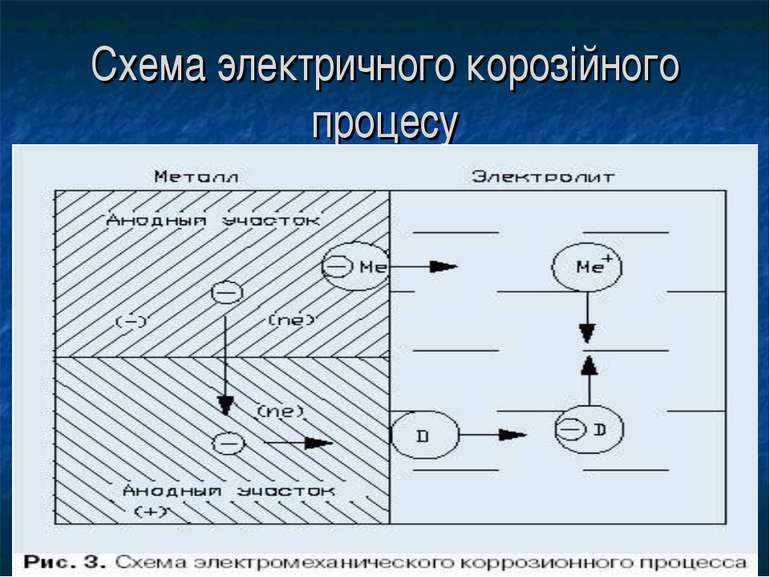
ЗМІСТ 2 ВСТУП 3 КОРОЗІЯ МЕТАЛУ 4 Швидкість корозії і класифікація агресивних середовищ 6 ВИДИ КОРРОЗИИ МЕТАЛІВ 9 Атмосферна корозія 9 Хімічна корозія 11 Електрохімічна корозія. 11 Потенціал. 12 Термодинаміка електрохімічної корозії металів. 12 Схема процесу електрохімічної корозії металів. 13 Гомогенні і гетерогенні шляху електрохімічної корозії. 14 Анодні процеси при електрохімічної корозії металів.
15 Корозія металу з кисневою деполяризацією 18 Корозія при дії вод, що не містять кисень. 21 Корозія при дії вод, що містять кисень. 22 Вплив рН на корозію сталі.
22 Види морської корозії 22 Гальванічна корозія 23 Корозія від блукаючих струмів 24 Щілинна корозія 25 Що таке специфічна корозія? 25 ЗАХИСТ ВІД КОРОЗІЇ 27 Інгібітори 27 Методи захисту металів від атмосферної корозії 28 ВСТУП Корозія - це руйнування твердих тіл, викликане хімічними та електрохімічними процесами, що розвиваються на поверхні тіла при його взаємодії із зовнішнім середовищем. Середа в якій метал піддається корозії (корродирует) називається корозійної або агресивним середовищем. У випадку з металами, кажучи про їх корозії, мають через небажаний процес взаємодії металу із середовищем. Слово корозія походить від латинського «corrodo» - «гризу». Деякі джерела посилаються на позднелатінськоє «corrosio» - «роз'їдання». Особливий збиток приносить корозія металів.
Поширений і найбільш знайомий усім нам вид корозії - іржавіння заліза, але не слід плутати поняття «корозія» і «іржа». Якщо корозія - це процес, то іржа один з його результатів.
Це слово можна застосувати тільки до заліза, що входить до складу сталі і чавуну. Згідно з міжнародним стандартом ISO 8044 під корозією металів розуміють фізико-хімічне або хімічну взаємодію між металом (сплавом) і середовищем, що приводить до погіршення функціональних властивостей металу (сплаву), середовища або охоплюють їх технічної системи. ІРЖА - це шар частково гідратованих оксидів заліза, що утворюється на поверхні заліза і деяких його сплавів в результаті корозії. Корозійного руйнування схильні також бетон, будівельний камінь, дерево, інші матеріали; корозія полімерів називається деструкцією. Крім корозії, конструкції піддаються дії ерозії - руйнування поверхні матеріалу під впливом механічної дії. Ерозію провокують дощі, вітри, піщаний пил та інші природні фактори. Тому арки мостів, будівельні ферми та інші споруди треба захищати комплексно.
Існує кілька видів корозії. Залежно від виду та характеристик середовища та умов протікання процесу розрізняють близько 40 видів корозії: атмосферну, газову, грунтову, морську, електрокорозії, кавитационную, кислотну, біокорозії та ін Як правило, металеві вироби та конструкції піддаються дії багатьох видів корозії - в цих випадках говорять про дію так званої змішаної корозії. По виду наносяться поразок корозія буває суцільною і локальної (піттінг, виразкова), підповерхневої, міжкристалітної, ниткоподібної, ножовий.
Результатом корозійного процесу може бути корозійне розтріскування і втомне руйнування. КОРОЗІЯ МЕТАЛУ Під корозією металу розуміють фізико-хімічну взаємодію металу з середовищем, що веде до його руйнування. В результаті корозії метали переходять в стійкі сполуки - оксиди або солі, у вигляді яких вони знаходяться в природі. За даними Інституту фізичної хімії РАН, кожна шоста домна в Росії працює 'даремно' - корозія з'їдає до 10 відсотків виробленого в країні металу. Корозія сталі і кольорових металів принципово відрізняється від корозійних процесів в неметалічних будівельних матеріалах. Більшість металів і сплавів, особливо сталь, більшою мірою схильні до корозії, ніж неметалеві матеріали.
Забруднення повітря, особливо поблизу хімічних заводів, призводить до значного прискорення процесів корозії. В результаті корозії відбуваються незворотні зміни - зменшення площі перетину і зниження міцності, а також часто зміна зовнішнього вигляду поверхні металу.
Вироби з металу піддаються корозії безперервно; під час їх виготовлення, транспортування, зберігання і, звичайно, експлуатації. На підтвердження сказаного наведемо такі приклади корозійного впливу:.
корозія металевих конструкцій автомобілів, сільськогосподарської, будівельної та іншої техніки в атмосфері;. роз'їдання хімічного обладнання різними хімічними речовинами;. руйнування парових котлів і охолоджувальних систем водою і парою;. руйнування підземних кабелів і трубопроводів;. вихід з ладу обладнання нафтових і газових свердловин і т.д.
Крім того, корозійного руйнування піддаються машини, вироби, запасні частини, прилади, що зберігаються на складах або транспортуються по морю або залізниці. Таким чином, збиток, що наноситься корозією, полягає не тільки у втраті маси металу, але і в погіршенні функціональних властивостей виробів, зниженні їх споживчої вартості і довговічності. І це, мабуть, найголовніше. Тому захист від корозії має величезне значення. Фізико-хімічної сутністю змін, які зазнає метал при корозії є окислення металу.
Будь корозійний процес є багатостадійним:. Необхідний підведення корозійної середовища або окремих її компонентів до поверхні металу. Взаємодія середовища з металом.
Повний або часткове відведення продуктів від поверхні металу (в об'єм рідини, якщо середу рідка). Відомо що більшість металів (крім Ag, Pt, Cu, Au) зустрічаються в природі в іонному стані: оксиди, сульфіди, карбонати та ін, звані зазвичай руди металів. Іонну стан більш вигідно, воно характеризується більш меншою внутрішньою енергією. Це помітно при одержання металів з руд та їх корозії. Поглинена енергія при відновленні металу із з'єднань свідчить про те, що вільний метал має більш високою енергією, ніж металеве з'єднання.
Це призводить до того, що метал знаходиться в контакті з корозійно-активним середовищем прагне перейти в енергетично вигідне стан з меншим запасом енергії. Тобто можна сказати, що першопричиною корозії металу є термодинамічна нестійкість металів в заданій середовищі. Характеристика корозійних процесів Корозія металів - руйнування металів внаслідок фізико-хімічного впливу зовнішнього середовища, при цьому метал переходить в окислене (іонне) стан і втрачає притаманні йому властивості.
По механізму корозійного процесу розрізняють два основних типи корозії: хімічну і електрохімічну. Під хімічної корозією розуміють взаємодія металевої поверхні з навколишнім середовищем, що не супроводжується виникненням електрохімічних (електродних) процесів на межі фаз. Механізм хімічної корозії зводиться до реактивної дифузії атомів або іонів металу крізь поступово товщає плівку продуктів корозії (наприклад окалини) і зустрічної дифузії атомів або іонів кисню. За сучасними поглядами цей процес має іонно-електронний механізм, аналогічний процесам електропровідності в іонних кристалах. Прикладом хімічної корозії є взаємодія металу з рідкими неелектролітами або сухими газами в умовах, коли волога на поверхні металу не конденсується, а також вплив на метал рідких металевих розплавів. Практично найбільш важливим видом хімічної корозії є взаємодія металу при високих температурах з киснем та ін газоподібними активними середовищами (HS, SO, галогени, водяні пари, CO та ін.) Подібні процеси хімічної корозії металів при підвищених температурах носять також назва газової корозії. Багато відповідальні деталі інженерних конструкцій сильно руйнуються від газової корозії (лопатки газових турбін, сопла ракетних двигунів, елементи електронагрівачів, колосники, арматура печей і т.д.).
Великі втрати від газової корозії (чад металу) несе металургійна промисловість. Стійкість проти газової корозії підвищується при введенні до складу сплаву різних добавок (хрому, алюмінію, кремнію та ін.) Добавки алюмінію, берилію і магнію до міді підвищують її опір газової корозії в окисних середовищах. Для захисту залізних і сталевих виробів від газової корозії поверхню виробу покривають алюмінієм (алитирование). Під електрохімічної корозією розуміють процеси взаємодії металів з електролітами (у вигляді водних розчинів, рідше з неводними електролітами, наприклад з деякими органічними електропровідними сполуками або безводними розплавами солей при підвищених температурах). Процеси електрохімічної корозії протікають за законами електрохімічної кінетики, коли загальна реакція взаємодії може бути розділена на наступні, в значній мірі самостійні, електродні процеси: Анодний процес - перехід металу в розчин у вигляді іонів (у водних розчинах, зазвичай гідратованих) із залишенням еквівалентної кількості електронів в металі.
Катодний процес - асиміляція що з'явилися в металі надлишкових електронів деполяризаторами. Розрізняють корозію з водневою, кисневою або окисної деполяризацией. Типи корозійних руйнувань.

При рівномірному розподілі корозійних руйнувань по всій поверхні металу корозію називають рівномірною. Якщо ж значна частина поверхні металу вільна від корозії й остання зосереджена на окремих ділянках, то її називають місцевою.
Виразкова, точкове, щілинна, контактна, межкрісталліческая корозія - найбільш часто зустрічаються в практиці типи місцевої корозії. Корозійне розтріскування виникає при одночасному впливі на метал агресивного середовища і механічних напруг. У металі з'являються тріщини транскристаллитного характеру, які часто призводять до повного руйнування виробів.